Programa Científico
Homeostasis de tejidos y órganos
UNIDADES EN ESTE PROGRAMA
Arquitectura celular y organogénesis Comunicación intercelular e inflamación
GRUPO DE INVESTIGACIÓN
Morfogénesis y neurodegeneración del Sistema Nervioso Central en vertebrados

Paola Bovolenta
¿Cómo surgen los defectos del neurodesarrollo y por qué envejece o degenera nuestro cerebro? Estas preguntas son la base de nuestra investigación, ya que conseguir unas respuestas es fundamental para poder, en un futuro, prevenir o tratar las numerosas enfermedades que afectan al sistema nervioso, evitando así sus graves consecuencias socio-económicas. Abordamos estas preguntas combinando el uso de distintos modelos experimentales (pez cebra, ratones y organoides humanos) con enfoques de biología celular y molecular.

Investigación
El cerebro y la retina, al igual que otras estructuras del sistema nervioso central (SNC), se desarrollan durante un periodo bastante largo de tiempo antes de llegar a su organización final. Este periodo tan largo es necesario para que millones de células neuronales adquieran, de una forma progresiva, su identidad final, estableciendo, además, entre ellas, una red de conexiones bastante elaborada. Conseguir una organización tan compleja es fundamental para nuestra vida cotidiana y nuestro bienestar. Con el envejecimiento, nuestro cerebro también cambia de una forma progresiva, pero desafortunadamente «en la dirección opuesta». Esto comienza a limitar nuestras capacidades para interaccionar con el entorno y otras personas. Cuando estos cambios son drásticos, como sucede en personas que pierden visión porque sus «fotorreceptores» degeneran o en aquellos que padecen la enfermedad de Alzheimer, realizar tareas sencillas o relacionarse con el entorno más próximo se vuelve prácticamente imposible. Por lo tanto, entender como se forma un cerebro en perfecto estado funcional y saber como preservarlo se encuentra en un punto intermedio entre la comprensión de su desarrollo y la identificación de las causas de su envejecimiento. Nuestro laboratorio divide su actividad entre estos dos extremos. Por un lado, investigamos a) cómo se forma el sistema visual; por el otro, b) buscamos las causas moleculares que subyacen a las alteraciones cerebrales que ocurren durante el envejecimiento y/o en la enfermedad de Alzheimer.
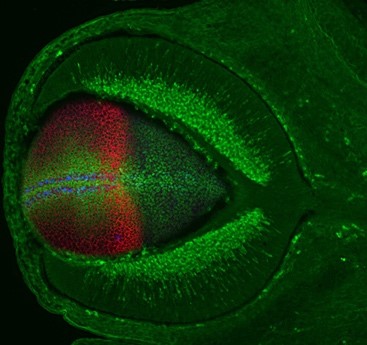
a) Durante más de veinte años, nuestro equipo ha contribuido a identificar y estudiar los componentes moleculares que coordinan el desarrollo del sistema visual de vertebrados. Apoyándonos en estos conocimientos, en la actualidad estamos investigando cómo se forma el epitelio pigmentario de la retina (RPE) y cómo este contribuye a la arquitectura global del ojo. El RPE está formado por una monocapa de células ubicada en la parte posterior de la retina neural. Su función, absolutamente indispensable para nuestra visión, es la de proteger, nutrir y apoyar la actividad de los fotorreceptores, las células de la retina encargadas de captar los estímulos lumínicos. Inicialmente es RPE esta compuesto de células neuroepiteliales aparentemente idénticas a las de la retina neural, pero rápidamente se transforman en una capa de células pigmentadas, cuboidales/escamosas (Figura 1). Se sabe muy poco de cómo ocurre esta transformación. Utilizando embriones de pez cebra y pollo como modelos, estamos estudiando los mecanismos celulares y moleculares que subyacen a esta transformación. Además, queremos entender si esta transformación es necesaria para que el ojo de los vertebrados adquiera su forma final de copa. En otras palabras, queremos saber cual es el impacto de una formación defectuosa del RPE sobre la forma que el ojo adquiere. De forma similar, también queremos conocer cómo se adapta el sistema visual a la formación anómala de algunos de sus componentes. Por ejemplo, ¿qué le ocurre al ojo si las estructuras visuales talámicas no se forman de forma adecuada?
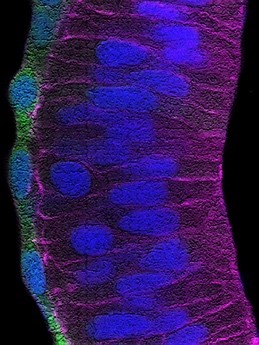
b) Cuando el cerebro envejece, el número de conexiones funcionales entre las distintas neuronas disminuye y el cerebro asume un estado de «inflamación» de bajo grado, pero crónico. Estos cambios se encuentran exacerbados en enfermedades neurodegenerativas como la enfermedad de Alzheimer (EA), caracterizada también por la acumulación de las típicas «placas amiloideas» (Figura 2). Desde un punto de vista molecular, la pérdida de conexiones, la inflamación y la formación de placas amiloideas tienen en común la actividad de la metaloproteasa ADAM10. Recientemente, nuestro grupo ha demostrado que una pequeña proteína secretada, conocida como Secreted Frizzled Related Protein 1 (SFRP1), actúa como un inhibidor endógeno de ADAM10. En base a esta observación, nos planteamos si era posible que parte de los rasgos patológicos de la EA fueran debidos a la presencia de niveles elevados de SFRP1, interfiriendo por lo tanto con la actividad de ADAM10. Nuestro trabajo ha validado esta hipótesis, demostrando que SFRP1 contribuye a la patogénesis de EA, mientras que la neutralización de su actividad en un modelo de ratón previene la progresión de la enfermedad y la pérdida de memoria presente en EA (o como consecuencia del envejecimiento). En base a este resultado alentador y aprovechando los diferentes modelos de ratones transgénicos que hemos generado, ahora estamos investigando la implicación directa de Sfrp1 en la pérdida de conexiones neuronales y en la inflamación presente en la EA y en el envejecimiento. Además, estamos explorando en mas detalle si la neutralización de SFRP1 puede representar una estrategia terapéutica eficaz contra la EA.
Miembros del grupo

Mª Jesús Martín Bermejo
Lab.: 426 Ext.: 4720
cbermejo(at)cbm.csic.es

Paula Bovolenta Nicolao
Lab.: 426 Ext.: 4718
pbovolenta(at)cbm.csic.es

Noemí Tabanera Anguita
Lab.: 426 Ext.: 4720
ntabanera(at)cbm.csic.es

María Elena Sánchez Bustamante
Lab.: 426 Ext.: 4720
elena.sanchez(at)externos.cbm.csic.es

Pablo Miaja Hernández
Lab.: 426 Ext.: 4720
pablo.miaja(at)cbm.csic.es

Marcos Martínez Baños
Lab.: 426 Ext.: 4720
mmartinez(at)cbm.csic.es

Eva Pajda Szeligowska
Lab.: 426 Ext.: 4720
eva.pajda(at)cbm.csic.es

Adrián Pérez Ramos
Lab.: 426 Ext.: 4720
adrian.perez(at)cbm.csic.es

Eleonora D'Ambra
Lab.: 426 Ext.: 4720
edambra(at)cbm.csic.es

Aikaterini Karkali
Lab.: 414 Ext.: 4465
k.karkali(at)cbm.csic.es
Publicaciones representativas
SFRP1 modulates astrocyte‐to‐microglia crosstalk in acute and chronic neuroinflammation
Javier Rueda‐Carrasco et al.

Cdon acts as a Hedgehog decoy receptor during proximal-distal patterning of the optic vesicle
Marcos Julián Cardozo et al.

Elevated levels of Secreted-Frizzled-Related-Protein 1 contribute to Alzheimer’s disease pathogenesis
Pilar Esteve et al.
Stretching of the retinal pigment epithelium contributes to zebrafish optic cup morphogenesis
Tania Moreno-Mármol et al.





